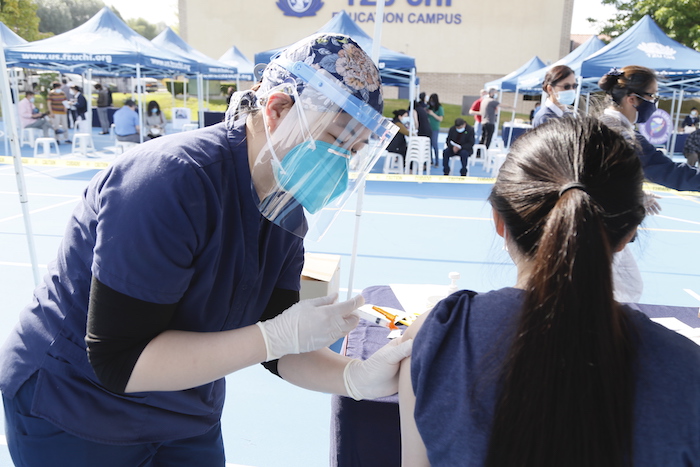
華盛頓訊
諾瓦瓦克斯公司(Novavax)研發的新冠疫苗13日獲得聯邦食品及藥物管理局(FDA)的緊急使用授權(EUA),該疫苗將可用於18歲以上的成年人。
諾瓦瓦克斯疫苗分兩劑接種,接種間隔為三個星期。該疫苗系新冠疫情開始之後,FDA核準的第四種疫苗。
諾瓦瓦克斯是一家總部位於馬裏蘭的小型生物技術企業,系2020年首批新冠疫苗研發的參與者,從聯邦政府獲得18億美元資金。
據統計,近77%的美國成年人已完成兩劑新冠疫苗的接種,一針未打的成年人尚有2700萬。FDA高級官員Peter Marks表示,諾瓦瓦克斯疫苗可能會對未接種疫苗的民眾有一定吸引力,因為他們可能更喜歡不是基於mRNA技術的疫苗。
諾瓦瓦克斯在人體細胞之外復製病毒刺突蛋白,然後將刺突蛋白的遺傳密碼置入受感染的蛾細胞的昆蟲病毒內,從而進行復製,並在製造過程中純化、抽取。成品復製刺突蛋白註入人體後,引發針對新冠病毒的免疫反應。
此外,諾瓦瓦克斯疫苗還使用一種稱為佐劑的額外成分,以誘發更廣的免疫反應。佐劑提取自南美的一種樹皮。諾瓦瓦克斯疫苗含5毫克復製刺突蛋白和50毫克佐劑。
FDA官員稱,與輝瑞和莫德納疫苗一樣,在年輕人當中,諾瓦瓦克斯疫苗似乎也存在心肌炎和心包炎風險。在參與臨床試驗的16歲至28歲人群中,發現4個相關病例。
本網站內容嚴禁未經授權轉載、複製。本網站僅為一般訊息平台,所發內容不代表本站立場,不構成任何投資、購買、要約等建議,不對資料之完整性、精確性等作任何保證。